Sobre o GT6 – Framework para Farmácia e Medicamentos
Escopo do GT6
Padronização relacionada às tecnologias de informação e comunicação ao domínio da farmácia e medicamentos, incluindo padronização para melhorias da segurança dos pacientes, a eficácia dos tratamentos e a interoperabilidade de sistemas de informação usados na pesquisa, desenvolvimento, regulação, distribuição e monitoramento de produtos farmacêuticos.
Missão do GT6
Ajudar na assistência aos pacientes por meio do uso seguro, efetivo e eficiente dos medicamentos. Este auxílio inclui o intercâmbio de dados com reguladores, entre parceiros da cadeia logística dos medicamentos e entre fornecedores de soluções de suporte à decisão, de bases de dados e de ferramentas de suporte `1a farmacoterapia e ao uso racional de medicamentos.
Objetivos do framework do GT6
Os objetivos do framework de trabalho do GT6 são:
- Apoiar as necessidades do stakeholders no desenvolvimento e manutenção de padrões que atendam a suas necessidades;\
- Coordenar os esforços do GT6 em conexão com os demais grupos do CEE 78 e com outras organizações vinculadas;
- Demonstrar o valor do GT6 para
- atrair novos especialistas na área de domínio do GT6
- avaliar a adoção e uso das normas GT6 em produtos de tecnologia da informação e comunicação
Cooperação e envolvimento
O GT6 deverá estabelecer relações de cooperação e envolvimento direto em projetos ou atividades que envolvam seu escopo de trabalho e cooperação das seguintes entidades
- Ministério da Saúde
- ANVISA
- Entidades e organizações do setor biofarmacêutico
- Centros de excelência para assistência à saúde e assistência farmacêutica
- Conselhos federais: medicina, farmácia, enfermagem, odontologia
- Entidades do terceiro setor envolvidas na segurança dos pacientes
Áreas de atuação
Desenvolvimento e regulação
- Identificação de Produtos Medicinais
- Princípios para manutenção de identificadores e termos
- Requisitos para Sistemas de Dicionários de Produtos Medicinais
- … eCTD – Electronic Common Technical Document
Cadeia logística e rastreabilidade
- Requisitos para a codificação de identificadores de embalagens de medicamentos legível por máquina
- Cadeia de custodia
Uso clínico dos medicamentos
- Requisitos para Sistemas de Dicionários de Produtos Medicinais
- Requisitos para instruções de uso estruturadas
- Requisitos para prescrição eletrônica
- Requisitos para registro eletrônico da dispensação
- Conceitos e definições de gestão farmacoterapêutica
- … Requisitos para alertas de segurança sobre medicamentos
- … Requisitos para o processo de administração de medicamentos
- … Acesso mobile a bulas de medicamentos
OBS: itens com reticências são itens planejados para o trabalho do ISO/WG6
Alguns descritivos das ações
- Processo regulatório de medicamentos
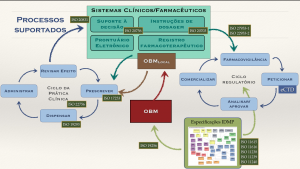
Este é o processo básico, composto pelas normas IDMP e as TS correspondentes. Desce a um nível de altíssima granularidade da informação, permitindo a identificação unívoca não só dos produtos mas também das substâncias (nome, onde foi fabricada, processo produtivo, vínculos com farmacopeias, etc.). Permite, inclusive a identificação de homeopatia, vacinas e fitoterápicos.
As normas são: 11238 (19844), 11239 (20440), 11240, 11615 (20443), 11616 (20451). Entre parênteses as Especificaçòes técnias correspondentes.
Mais recentemente houve a publicação da 16791 que estabelece critérios básicos para o rastreamentos de cada instância de medicamento no mercado. O Brasil está com aguda necessidade de agregar inteligência em seu processo de rastreabilidade (Sistema Nacional de Controle de Medicamentos) e poderíamos auxiliar muito o país.
- Uso clínico dos medicamentos
A partir da existência de uma informação estruturada e altamente granular, é possível torná-la mais significativa para uso nos processos do ciclo da assistência farmacêutica e prescrição (seleção – aquisição – transporte – armazenamento – distribuição – prescrição – dispensação – administração). Nesse contexto, a informação disponível no nível anterior (IDMP) seria agregada e organizada em níveis superiores de abstração, permitindo seu uso por profissionais de saúde.
É o que a ISO chama de Dicionário de Produtos Medicinais e o Brasil chamou de Ontologia Brasileira de Medicamentos.
Dessa necessidade derivaram diversas normas que estruturam os requisitos de informação nas diversas etapas:
19256 – Dicionários de produtos medicinais
20831 – Gestão farmacoterapêutica
22756 – Base de conhecimentos sobre medicamentos ( reações adversas, indicações, contraindicações, etc.)
19923 – Dispensação
17253 – Prescrição
17251 – Sintaxe para dosagem
- Processo de avaliação e monitoramento do uso
Entra então em cena a necessidade de monitorar os efeitos (desejados e não desejados) dos medicamentos. Para isso a ISO trabalhou com o ICH nas normas de farmacovigilância (27953-1 e 27953-2) e na emissão de alertas de risco farmacoterapêutico (22703).
Uma nova proposta de trabalho visará o estabelecimento de requisitos para bases de conhecimento sobre medicamentos.
Figura 1 – Processos suportados pelo framework do GT6